蜱虫虽小,危害却不可小觑。蜱类是人类、野生动物和家畜的多种病原体的载体,但在分子水平上人们对蜱类的了解仍然有限。这与蚊子等昆虫形成了鲜明对比,因为目前已有大量的转基因和基因组编辑工具适用于蚊子研究。为改变这一现状,研究人员使用CRISPR-Cas9编辑技术成功地改变了黑脚蜱的基因组。他们开发了一种胚胎注射方法,克服了该领域的主要障碍。2月16日,相关论文发表在细胞出版社(Cell Press)旗下期刊iScience(《交叉科学》)上。
“尽管蜱类具有获得和传递一系列病原体的能力,但对它们的研究一直落后于蚊子等其他节肢动物,主要原因是现有的遗传和分子工具难以用于蜱类研究。”该论文共同通讯作者、美国内华达大学雷诺分校分子生物学家Monika Gulia-Nuss说。
“有了可用的基因编辑工具,我们就能解开蜱类基因组的一些秘密,将有助于确定这些独特的动物如何在环境中生存、如何与病原体相互作用,以及如何防止蜱类向人类和牲畜传播疾病。”她说。
新论文另一位共同通讯作者、内华达大学雷诺分校昆虫学家Andrew Nuss说:“基因编辑领域的进展对于研究解决蜱传疾病带来的日益严重的问题至关重要。”
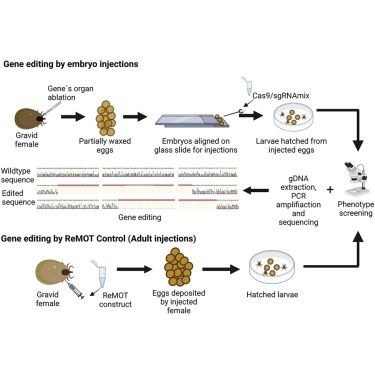
CRISPR-Cas9技术已经彻底改变了许多生物的功能遗传学研究。这种基因编辑技术已被应用于蚊子等节肢动物疾病载体,但未能编辑蜱类基因。而且,蜱虫胚胎注射编辑技术面临的挑战进一步减缓了研究进展。蜱虫胚胎注射非常困难,因为研究人员必须在注射前解决卵内高压、坚硬绒毛膜和胚胎外蜡层等问题。
这一次,研究人员开发了一种蜱虫胚胎注射新方案,并使用CRISPR-Cas9技术进行了靶向基因破坏。他们借助了胚胎注射和受体介导的卵巢货物转导(ReMOT Control)—— 一种劳动强度更低的节肢动物基因编辑方法。
通常,雌性蜱虫使用一种叫做Gené的器官为卵包裹一层坚硬的蜡层。于是,研究人员切除了雌蜱的Gené,防止蜡沉积,然后用苯扎氯铵和氯化钠处理这些卵,以去除绒毛膜,并降低卵内的压力。
“我们能够仔细地解剖怀孕的雌蜱,用手术切除Gené器官,但仍能让雌蜱产卵。向这些不含蜡的卵注射基因组修改所需的材料更容易。”Gulia-Nuss说,“另一个重大挑战是了解蜱虫胚胎发育的时间。我们对蜱虫胚胎学所知甚少,所以需要确定引入CRISPR-Cas9的精确时间,以确保诱导基因改变。”
结果显示,注射后胚胎的存活率约为10%,与成熟的昆虫模型相当。在ReMOT Control组中,所有注射的蜱虫都存活了下来。这些数据表明,用这两种方法注射蜱虫胚胎和对蜱类进行基因操作是可行的。
“此前,没有实验证明可以修饰蜱类基因组。有些人认为这在技术上太难实现了。” Nuss说,“这是第一次有研究表明,蜱虫的遗传转化可能通过两种不同的方法实现。”
不过,研究人员表示,需要更多研究来了解蜱虫高效基因编辑的分子机制。虽然这些工具将加速蜱类基因研究,但仍需要改进胚胎注射方法,以提高存活、幼虫孵化和基因编辑效率。
“我们希望开发的新工具将带来新的研究途径,大大加速我们对蜱类及相关物种的分子生物学研究。” Gulia-Nuss说,“有针对性地破坏蜱虫基因,是揭示蜱虫—病原体—宿主相互作用的潜在生物学的有力方法,可以为蜱传疾病控制新方法的开发和应用提供信息。”(经济日报记者 佘惠敏)
上一篇:生气伤肝,生活中若是不注意控制情绪,或许容 下一篇:没有了